फैराडे के विद्युत अपघटन के नियम (phairade ke vidyut apghatan ke niyam)
सन् 1853 में इंग्लैंड के वैज्ञानिक माइकल फैराडे ने विद्युत अपघटन की क्रिया का अध्ययन करके दो नियमों का प्रतिपादन किया , जिन्हें फैराडे के विद्युत अपघटन के नियम कहते हैं ।
प्रथम नियमः - विद्युत अपघटन की क्रिया में किसी इलेक्ट्रोड पर मुक्त ( जमा ) हुए पदार्थ का द्रव्यमान ( m ) उसमें प्रवाहित आवेश की मात्रा के समानुपाती होता है ।
अर्थात् m ∝ Q
द्वितीय नियम : - यदि विभिन्न विद्युत अपघट्यों में समान प्रबलता को विद्युत धारा समान समय तक प्रवाहित की जाए तो इलेक्ट्रोडों पर जमा हुए पदार्थों के द्रवामान उनके विद्युत रासायनिक तुल्यांक ( E ) के समानुपाती होते है ।
अर्थात m ∝ E
विद्युत के रासायनिक तुल्यांक का मान परमाणु भार और संयोजकता के अनुपात के बराबर होता है
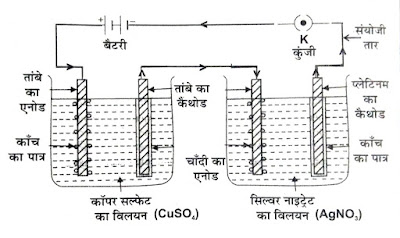
उदाहरण के लिए : कॉपर सल्फेट के विलयन व सिल्वर नाइट्रेट के विलयन में । एम्पियर की धारा । समय तक प्रवाहित करने पर , विद्युत अपघट्य Cuso , के इलेक्ट्रोड पर m , द्रव्यमान तांबा तथा विद्युत अपघट्य AgNO , के इलेक्ट्रोड पर m , द्रव्यमान चांदी जमा होती है तब इस नियमानुसार
M2
E2
जिन पात्रों में कॉपर सल्फेट तथा सिल्वर नाइट्रेट का विद्युत अपघटन किया जाता है, उन्हें क्रमशाह ताम्र वोल्ट मीटर व रजत वोल्ट मीटर कहते हैं
तांबे का रासायनिक तुल्यांक -
E1 =
2
चांदी का रासायनिक तुल्यांक -
E2 =
1